Cara Merubah Sendiri Air H20 Menjadi Bahan Bakar Gas Hidrogen H2 - Hallo sahabat begini caranya, Sharing kali ini berjudul : Cara Merubah Sendiri Air H20 Menjadi Bahan Bakar Gas Hidrogen H2, mudah-mudahan isi postingan yang saya tulis ini dapat temans pahami dan bermanfaat buat teman teman semua, kalo bermanfaat jangan lupa di share biar banyak yang tau.

Mau Pempers Gratis Premium Care New Born isi 13 Gratis ? Tersedia 40 Ribu Paket Sample Gratis Isi 13 Pcs untuk Anda !
Good Luck!
Cek Info Promo Berikutnya Di Sini
Berawal dari penemuan Jules Verne di tahun 1874, ketika dia melakukan penelitian tentang elektrolisa air yang menghasilkan gas H2 dan O2, yang mana ternyata gas H2 dapat meledak ketika dibakar, oleh sebab itu didalam bukunya The Mysterious Island dia menulis; ”kami yakin bahwa suatu hari air akan digunakan sebagai bahan bakar, bahwa hydrogen dan oksigen yang menyusunnya, digunakan sendiri-sendiri atau bersama-sama, akan menjadi sumber panas dan cahaya yang tidak ada habisnya, dengan daya yang batu bara tak mampu menghasilkannya.”
Elektrosisa terbagi menjadi dua, yaitu :
Elektrolisa Basah adalah elektrolisa yang biasa digunakan sampai saat ini, yaitu dengan memasukan kedua plat kondensator tersebut kedalam air destilasi atau air RO (Reverse Osmosis = air murni), apabila kedua elektroda tersebut diberi tegangan listrik maka akan terjadi proses pemisahan H2 dan O2, kemudian hasil H2 tersebut perlu dihitung dan di-data dari hasil percobaan, selain itu perlu diteliti variabel yang mempengaruhi produksi H2 tersebut, sehingga dapat diambil kesimpulan penggunaan elektrolisa yang paling efisien & efektif. Elektrolisa Kering (Dry electrolyze) merupakan perkembangan baru yang biasanya disebut Dry-cell, pada proses ini plat kondensotornya tidak direndam kedalam larutan akan tetapi plat-nya berada disebelah luar dan larutannya didalam plat tersebut. Pada proses dry cell panas yang ditimbulkan oleh plat kondensator dapat dibuang langsung keluar, sehingga tidak membuat larutan menjadi lebih panas, dibandingkan dengan elektrolisa biasa atau elektrolisa basah (Wet Electrolyze).
Rumus Kimia pada proses Elektrolisa:
Pada elektroda Kathoda terjadi penambahan elektron (e−), sehingga reaksi kimia yang terjadi sebagai berikut :
Kathode (reduksi):
Reaksi : Elektrolisis larutan KOH dalam air :
Reaksi : Elektrolisis larutan Na2CO3 dalam air :
Dalam penerapannya elektrode yang digunakan adalah stainless steell yang dapat dikategorikan sebagai elektrode inert, dari percobaan yang kami lakukan pada beberapa kendaraan bermotor, untuk mobil 1000 CC dengan kecepatan 50-60 km/jam dengan konsumsi BBM (besin) 1 liter dapat menempuh jarak 12 km, sehingga waktu yang diperlukan 12/60 jam = 12 menit. Jika dihitung kalor yang dihasilkan pada pembakaran sempurna 1 liter bensin (oktana) dengan reaksi : Ramsden E.N (2000 : 499).
3. Dengan penambahan gas hidrogen dan gas oksigen pada ruang pembakaran, proses oksidasi dan performa mesin meningkat, diikuti dengan penurunan residu karbon pada ruang pembakaran, penurunan emisi gas buang karbomonoksida (CO), dan hidrokarbon/ bensin yang tidak terbakar
Pada sepeda motor 4 langkah konsumsi bahan bakar menjadi perhatian penting dikhawatirkan dengan CC yang besar konsumsi bahan bakar semakin meningkat. Maka dengan penggunaan HHO GENERATOR konsumsi bahan bakan menjadi lebih irit dibandingkan tidak menggunakan HHO GENERATOR. Dimana HHO GENERATOR mampu menggabungkan hydrogen dengan pengkabutan udara hasil dari bensin yang bercampur udara di ruang bakar kendaraan bermotor, yang menghasilkan efisiensi penggunaan bahan bakar sebesar 50% dari pemakaian normal.
Dengan memasang HHO GENERATOR di ruang mesin, isi HHO GENERATOR dengan air destilasi, aliri dengan listrik DC, dan HHO GENERATOR akan memproduksi gas HHO (hidrogen+oksigen) untuk disupply ke ruang bakar. Gas HHO disuplai ke ruang bakar melalui intake manifold atau filter udara.
Para peneliti di University of East Anglia telah melaporkan terobosan dalam generasi hidrogen dari air, dengan sistem baru yang mencapai efisiensi 60 persen untuk sebuah proses di mana hidrogen dihasilkan dari air oleh foton mencolok sebuah elektroda yang dirancang khusus. Teknologi ini didasarkan pada penggunaan nanophotocathode, yang dilapisi emas elektroda dengan nanoclusters dari phosphide indium.
Terima kasih atas kunjungannya di begini caranya info yang sudah anda baca : Cara Merubah Sendiri Air H20 Menjadi Bahan Bakar Gas Hidrogen H2, bisa anda share dengan link :
https://beginicarabikinnya.blogspot.com/2015/09/cara-merubah-sendiri-air-h20-menjadi.html
Cara Merubah Sendiri Air H20 Menjadi Bahan Bakar Gas Hidrogen H2
Penduduk dunia saat ini benar - benar masih tergantung dengan sumber energi bahan bakar minyak, manusia belum dapat melepas ketergantungan energinya dengan BBM, walaupun demikian, para ilmuan tetap bekerja keras untuk menemukan energi alternatif pengganti BBM yang hampir punah itu. ternyata untuk mendapatkan energi alternatif itu tak perlu ilmuan hebat, karena anda pun dapat menciptakan, energi alternatif itu adalah Hidrogen, ini adalah unsur paling melimpah di bumi kita, dengan persentase kira-kira 75% dari total massa unsur alam semesta. Karena itulah para ilmuwan dan peneliti mulai memikirkan untuk menjadikan hidrogen sebagai bahan bakar bersih masa depan. Bagaimana Caranya Merubah Air H20 Menjadi Bahan Bakar Gas Hidrogen H2 ? Ayo Pelajari Caranya !!! agar kita dengan mudah Merubah Sendiri Air H20 Menjadi Bahan Bakar Gas Hidrogen H2.
Sebelum Kita Membahas Lebih Jauh, Mari Kita simak Video di bawah ini yang Membuktikan Bahwa Air Bisa Di Rubah Menjadi Gas Hidrogen.
Good Luck!
Cek Info Berikutnya Di Sini
Sebelum Kita Membahas Lebih Jauh, Mari Kita simak Video di bawah ini yang Membuktikan Bahwa Air Bisa Di Rubah Menjadi Gas Hidrogen.
Good Luck!
Cek Info Berikutnya Di Sini

Mau Pempers Gratis Premium Care New Born isi 13 Gratis ? Tersedia 40 Ribu Paket Sample Gratis Isi 13 Pcs untuk Anda !
Good Luck!
Cek Info Promo Berikutnya Di Sini
Dengan melalui proses Fischer-Tropsch yakni sebuah proses kumpulan reaksi kimia yang mengubah campuran karbon monoksida dan hidrogen menjadi hidrokarbon cair, dalam demonstrasinya para ilmuwan itu mampu menghasilkan bahan bakar sintetis yang dapat digunakan untuk menjalan kendaraan dan mesin.
Proses ini sebenarnya bukanlah hal baru, sebelumnya dua orang ilmuwan dari German bernama Franz Fischer dan Hans Tropsch telah menemukan metode ini pada tahun 1925 lalu dengan tambahan metode solid oxide electrolyser cells (SOECs) dan kini proses pembuatannya telah disempurnakan oleh para ilmuwan di Sunfire GmbH. Secara garis besar, proses pembuatanya adalah sebagai berikut; penggunaan unsur hidrogen ini dimaksudkan untuk mengurangi karbon dioksida (CO2) yang dihasilkan dari atmosfer, kemudian diendapkan menjadi biogas atau dikumpulkan dengan menggunakan pengolahan limbah gas.
Selanjutnya karbon monoksida dan hidrogen yang dihasilkan kemudian disintesis menjadi bahan bakar dengan kemurnian tinggi dengan menggunakan proses Fischer-Tropsch tadi. Kelebihan panas dari proses ini kemudian digunakan untuk menciptakan lebih banyak uap, pihak Sunfire mengklaim bahwa proses ini telah meningkatkan efisiensi hingga 70 persen.
Coba Saja anda pikiran pastinya pada teknologi yang akan datang hydrogen akan sangat banyak diteliti oleh para ahli. Berikut adalah salah satu aplikasi bahan bakar untuk memproduksi hydrogen, yaitu menkonversi air (H20) menjadi gas hydrogen (H2) dengan cara elektrolisis dengan menggunakan HHO Generator, teknik elektrolisis ini pertama kali ditemukan oleh Michael Faraday .
Coba Saja anda pikiran pastinya pada teknologi yang akan datang hydrogen akan sangat banyak diteliti oleh para ahli. Berikut adalah salah satu aplikasi bahan bakar untuk memproduksi hydrogen, yaitu menkonversi air (H20) menjadi gas hydrogen (H2) dengan cara elektrolisis dengan menggunakan HHO Generator, teknik elektrolisis ini pertama kali ditemukan oleh Michael Faraday .
Berawal dari penemuan Jules Verne di tahun 1874, ketika dia melakukan penelitian tentang elektrolisa air yang menghasilkan gas H2 dan O2, yang mana ternyata gas H2 dapat meledak ketika dibakar, oleh sebab itu didalam bukunya The Mysterious Island dia menulis; ”kami yakin bahwa suatu hari air akan digunakan sebagai bahan bakar, bahwa hydrogen dan oksigen yang menyusunnya, digunakan sendiri-sendiri atau bersama-sama, akan menjadi sumber panas dan cahaya yang tidak ada habisnya, dengan daya yang batu bara tak mampu menghasilkannya.”
Kembali kepada penemuan Jules Verne memang sangat menarik bahwasanya air bisa menjadi bahan bakar motor bakar bensin maupun diesel, sejauh ini memang sudah sangat maju sekali perkembangannya, pelopor yang sangat terkenal dalam penggunaan H2 sebagai bahan bakar motor bensin dan solar adalah Stanley Meyer, yang akhirnya dibunuh dengan racun oleh sebagian orang yang mempunyai kepentingan dalam bisnis minyak bumi. Tetapi seperti pepatah kita “hilang satu tumbuh seribu” itulah yang sekarang terjadi, dimana-mana diseluruh dunia sekarang ini diramaikan dengan elektrolisa air atau ada juga yang menyebutnya hydrolisa air atau HHO Generator.
Air sebagai sumber daya yang dapat diperbaharui dapat diberdayakan menggunakan HHO GENERATOR. HHO GENERATOR dapaat melakukan elektrolisasi yang merubah air (H20) menjadi hydrogen (H2). Pada pembahasan ini, akan dibahas proses elektrolisasi air (H20) menjadi hydrogen (H2) dengan alat HHO GENERATOR.
Sudah lebih dari 80 tahun proses elektrolisa ini dipergunakan secara komersial, seperti halnya penyepuhan emas, perak dan lain sebagainya. Prinsip Elektrolisa pada air biasa adalah untuk memecahkan ikatan kimia air (H2O) menjadi H2 dan O2, diperlukan tegangan listrik searah (DC), yg dialirkan melalui lempengan plat stainless.
Pada lempengan plat Kathoda bermuatan (-) akan terjadi / terkumpul gas H2 dan pada bagian plat Anoda bermuatan (+) akan terkumpul gas O2, kedua bentuk gas tersebut akan keluar bersama-sama sehingga gas tersebut disebut gas HHO. Dalam proses elektrolisa ini diperlukan elektrolit seperti KOH, NaOH atau Backing soda dll. Elektrolit tersebut gunanya untuk menyalurkan arus listrik didalam air. Apabila gas H2 tersebut dipergunakan untuk pembakaran maka gas O2 yang masih bercampur tersebut tidak menjadikan halangan pembakaran karena setiap pembakaran memerlukan O2, bahkan HHO mempunyai kelebihan, tanpa O2 dari luar dapat dinyalakan atau dibakar.
HHO GENERATOR adalah alat elektrolisa air yang memproduksi hydrogen (H2) yang tersimpan didalam air (H2O), sehingga air (H2O) dapat ter-pisahkan menjadi H2 (hydrogen) dan O2 (oksigen). Proses elektrolisa air dikenal juga sebagai elektrolisa alkalis, karena untuk berjalannya proses elektrolisa ini diperlukan larutan katalisator yaitu larutan alkalis (seperti KOH, NaOH, Baking Soda dan sebagainya.).
Proses elektrolisa menggunakan 2 buah plat kondensator, satu plat digunakan untuk elektroda Kathoda (-) dan yang satu lagi untuk elektroda anoda (+), kedua plat kondensator tersebut ter-rendam dalan cairan Air yang dicampur dengan KOH, apabila Kathoda dan Anoda diberi tegangan listrik maka akan terjadi pada elektroda kathoda akan terkompres gas H2 dan pada elektroda anoda terkompress O2 , hasil dari perpecahan tersebut dapat digunakan gas H2 nya untuk menambah atau mengganti sebagian dari bahan bakar yang digunakan untuk kendaraan bermotor, sehingga akan mengurangi pemakaian bahan bakar itu sendiri secara otomatis.
Air sebagai sumber daya yang dapat diperbaharui dapat diberdayakan menggunakan HHO GENERATOR. HHO GENERATOR dapaat melakukan elektrolisasi yang merubah air (H20) menjadi hydrogen (H2). Pada pembahasan ini, akan dibahas proses elektrolisasi air (H20) menjadi hydrogen (H2) dengan alat HHO GENERATOR.
Sudah lebih dari 80 tahun proses elektrolisa ini dipergunakan secara komersial, seperti halnya penyepuhan emas, perak dan lain sebagainya. Prinsip Elektrolisa pada air biasa adalah untuk memecahkan ikatan kimia air (H2O) menjadi H2 dan O2, diperlukan tegangan listrik searah (DC), yg dialirkan melalui lempengan plat stainless.
Pada lempengan plat Kathoda bermuatan (-) akan terjadi / terkumpul gas H2 dan pada bagian plat Anoda bermuatan (+) akan terkumpul gas O2, kedua bentuk gas tersebut akan keluar bersama-sama sehingga gas tersebut disebut gas HHO. Dalam proses elektrolisa ini diperlukan elektrolit seperti KOH, NaOH atau Backing soda dll. Elektrolit tersebut gunanya untuk menyalurkan arus listrik didalam air. Apabila gas H2 tersebut dipergunakan untuk pembakaran maka gas O2 yang masih bercampur tersebut tidak menjadikan halangan pembakaran karena setiap pembakaran memerlukan O2, bahkan HHO mempunyai kelebihan, tanpa O2 dari luar dapat dinyalakan atau dibakar.
HHO GENERATOR adalah alat elektrolisa air yang memproduksi hydrogen (H2) yang tersimpan didalam air (H2O), sehingga air (H2O) dapat ter-pisahkan menjadi H2 (hydrogen) dan O2 (oksigen). Proses elektrolisa air dikenal juga sebagai elektrolisa alkalis, karena untuk berjalannya proses elektrolisa ini diperlukan larutan katalisator yaitu larutan alkalis (seperti KOH, NaOH, Baking Soda dan sebagainya.).
Proses elektrolisa menggunakan 2 buah plat kondensator, satu plat digunakan untuk elektroda Kathoda (-) dan yang satu lagi untuk elektroda anoda (+), kedua plat kondensator tersebut ter-rendam dalan cairan Air yang dicampur dengan KOH, apabila Kathoda dan Anoda diberi tegangan listrik maka akan terjadi pada elektroda kathoda akan terkompres gas H2 dan pada elektroda anoda terkompress O2 , hasil dari perpecahan tersebut dapat digunakan gas H2 nya untuk menambah atau mengganti sebagian dari bahan bakar yang digunakan untuk kendaraan bermotor, sehingga akan mengurangi pemakaian bahan bakar itu sendiri secara otomatis.
Elektrosisa terbagi menjadi dua, yaitu :
- Eletrolisa basah (wet electrolyze)
- Elektrolisa kering (Dry electrolyze)
Elektrolisa Basah adalah elektrolisa yang biasa digunakan sampai saat ini, yaitu dengan memasukan kedua plat kondensator tersebut kedalam air destilasi atau air RO (Reverse Osmosis = air murni), apabila kedua elektroda tersebut diberi tegangan listrik maka akan terjadi proses pemisahan H2 dan O2, kemudian hasil H2 tersebut perlu dihitung dan di-data dari hasil percobaan, selain itu perlu diteliti variabel yang mempengaruhi produksi H2 tersebut, sehingga dapat diambil kesimpulan penggunaan elektrolisa yang paling efisien & efektif. Elektrolisa Kering (Dry electrolyze) merupakan perkembangan baru yang biasanya disebut Dry-cell, pada proses ini plat kondensotornya tidak direndam kedalam larutan akan tetapi plat-nya berada disebelah luar dan larutannya didalam plat tersebut. Pada proses dry cell panas yang ditimbulkan oleh plat kondensator dapat dibuang langsung keluar, sehingga tidak membuat larutan menjadi lebih panas, dibandingkan dengan elektrolisa biasa atau elektrolisa basah (Wet Electrolyze).
Rumus Kimia pada proses Elektrolisa:
Pada elektroda Kathoda terjadi penambahan elektron (e−), sehingga reaksi kimia yang terjadi sebagai berikut :
Kathode (reduksi):
2H+(cair) + 2e−→ H2(gas).
Sedangkan pada elektroda Anoda, terjadi proses oxidasi dimana pelepasan elektron yang bergerak kearah elektroda kathoda, reaksi kimia pada Anode sebagai berikut Anode (oxidasi) :
2H 2O (l) → O2(gas) + 4H+(cair) + 4e− ; (l = Larutan).
Reaksi kimia penyeimbangan, reaksi air dengan larutan basa sebagai berikut;
Katode (reduksi): 2H 2O (l) + 2e− → H2(gas) + 2OH−(cair)
Anode (oxidasi) : 4OH−(cair) → O2(gas) + 2H 2O (l) + 4e−.
Sehingga dapat ditulis untuk keseluruhan reaksi pemecahan H2 dan O2 ;
Reaksi keseluruhan:
Sehingga dapat ditulis untuk keseluruhan reaksi pemecahan H2 dan O2 ;
Reaksi keseluruhan:
2H 2O (l) → 2H2(gas) + O2(gas).
Dari persamaan reaksi kimia yang terjadi, jumlah volume H2 gas besarnya atau volumenya adalah 2 X lebih banyak dari jumlah volume O2 gas.
Pada elektrolisis larutan elektrolit akan dihasilkan zat zat hasil reaksi yang tergantung pada harga potensial reduksi ion-ion yang ada dalam larutan dan elektrode yang digunakan. Jumlah zat hasil elektrolisis bergantung besarnya jumlah listrik yang digunakan, untuk menghasilkan gas Hidrogen dan gas Oksigen dapat digunakan larutan elektolit dari Kalium Hidroksida (KOH) atau menggunakan garam sulfat atau karbonat dari unsur-unsur golongan IA seperti Natrium Sulfat (Na2SO4), Natrium Karbonat (Na2CO3), Natrium Hidroksida (NaOH) atau garam lain yang mudah didapat dan ekonomis.
Hanya saja, berdasarkan percobaan yang telah dilakukan, penggunaan elektrolit yang mengandung Natrium (Na) akan menimbulkan kristalisasi garam Na pada saluran Udara tempat dimana diinjeksikan Gas HHO ke dalam ruang bakar, serta timbul kristalisasi garam Na pada Throttle.
Elektrolisa Air akan menghasilkan Gas HHO:
Elektrolisa Air akan menghasilkan Gas HHO:
- 1 Liter Air = 1,750 Liter Gas
- Bentuk Gas HHO yang terjadi ada 14 macam
- Flame Speed 1,300 Mtr/Detik pada kondisi Vakum (P abs = - 820 mmHg)
- Self Ignite: T = 550 C pada P = 15 Psi
Reaksi : Elektrolisis larutan KOH dalam air :
Katoda : [2H2O(l) + 2e → 2OH-(aq) + H2(g)] x 2
Anoda : 4OH-(aq) → 2H2O(l) + O2(g) + 4e +
2H2O(l) → 2 H2(g) + O2(g)
Reaksi : Elektrolisis larutan Na2CO3 dalam air :
Katoda : [2H2O(l) + 2e → 2OH-(aq) + H2(g)] x 2
Anoda : 2H2O(l) → 4H+(aq) + O2(g) + 4e +
2H2O(l) → 2 H2(g) + O2(g)
Pada elektrolisis larutan yang mengandung ion-ion golongan IA (Na+, K+), ion-ion tersebut tidak tereduksi pada katode tetapi air yang mengalami reduksi karena potensial reduksi air lebih besar dari potensial reduksi ion Natrium atau ion Kalium (Eo H2O/H2 = - 0,83 volt dan EoNa+/Na = - 2,71 volt).
Dalam penerapannya elektrode yang digunakan adalah stainless steell yang dapat dikategorikan sebagai elektrode inert, dari percobaan yang kami lakukan pada beberapa kendaraan bermotor, untuk mobil 1000 CC dengan kecepatan 50-60 km/jam dengan konsumsi BBM (besin) 1 liter dapat menempuh jarak 12 km, sehingga waktu yang diperlukan 12/60 jam = 12 menit. Jika dihitung kalor yang dihasilkan pada pembakaran sempurna 1 liter bensin (oktana) dengan reaksi : Ramsden E.N (2000 : 499).
C8H18(g) + 25/2 O2(g) → 8 CO2(g) + 9H2O(g) rHo= – 5510 kJ/mol
Reaksi ini berlangsung pada ruang pembakaran, dimana bahan bakar minyak mempunyai titik didih 150oC dan akan berbentuk uap pada ruang pembakaran mesin.
Massa 1 mol C8H18= (8.12 + 18. 1) gram (Ar C = 12 dan H = 1) = 114 gram
Untuk membakar 1 mol C8H18 atau 114 gram C8H18 dibebaskan kalor = 5510 kJ.
Massa jenis bensin = 0,77 kg/L sehingga massa 1 L bensin = 770 gram, jadi kalor yang dihasilkan = 770/114 x 5510 kJ = 37216,66 kJ
Jadi kalor yang dihasilkan pada pembakaran 1 gram bensin = 37216,66 kJ/770 gram = 48,333 kJ
Pada pembakaran bensin oktana emisi gas buang masih mengandung gas CO sebanyak 5%.
Pada perakitan alat elektrolisis yang dipasang pada mobil digunakan diode dengan kuat arus 25 Ampere, digunakan dalam waktu yang sama 12 menit gas hidrogen yang dihasilkan sebagai berikut :
Massa H2 = ME H2. i . t /96500 gram = 1. 25. 12. 60/96500 gram = 0,186528 gram
Pembakaran sempurna gas H2menurut reaksi :
H2(g) + ½ O2(g) → H2O(g) rHo = -241,82 kJ/mol
Pada pembakaran 1 mol atau 2 gram gas hidrogen dihasilkan kalor = 241,82 kJ
Untuk pembakaran sempurna 1 gram gas hidrogen dihasilkan kalor = 120,91 kJ
Untuk pembakaran 0,186528 gram dibebaskan kalor = 0,186528/2 x 241,82 kJ = 22,5531 kJ
Sedangkan gas oksigen yang dihasilkan dari proses elektrolisis yang sama :
Massa O2 = ME O2. i . t /96500 gram = 32/4 . 25. 12. 60/96500 gram = 1,49223 gram
Volume gas O2 yang dihasilkan jika diukur pada suhu 25oC dan tekanan 1 atm adalah PV = nRT
atau V = n RT/P
V gas O2 = 1,49223/32. 0,082056872. 298/1 Liter = 1,14027 Liter
Oksigen yang dihasilkan ini akan sangat berperan didalam proses pembakaran, sehingga pembakaran akan berlangsung lebih sempurna dan bahan bakar akan semakin hemat.
Berdasarkan dari hasil perhitungan kalor yang dihasilkan pada pembakaran sempurna 1 mol gas H2hasil elektrolisis, yang diukur pada suhu kamar besarnya entalpi sama dengan entalpi pembentukan 1 mol uap air. Dengan menggunakan arus listrik 25 ampere dan waktu yang sama dengan waktu yang digunakan untuk melakukan pembakaran bensin dengan kendaraan bermotor selama 12 menit ternyata diperoleh kalor 22,5531 kJ. Jika dibandingkan kalor yang dihasilkan pada pembakaran 1 gram besin (oktana) dengan 1 gram gas Hidrogen = 48,333 kJ : 120,91 kJ. Dari hasil ini terlihat bahwa penambahan gas hidrogen dari elektrolisis kedalam ruang pembakaran akan menghasilkan tambahan energi yang cukup besar sehingga performa mesin akan lebih bagus dan lebih hemat dalam pemakaian bahan bakar.
Berdasarkan dari hasil perhitungan kalor yang dihasilkan pada pembakaran sempurna 1 mol gas H2hasil elektrolisis, yang diukur pada suhu kamar besarnya entalpi sama dengan entalpi pembentukan 1 mol uap air. Dengan menggunakan arus listrik 25 ampere dan waktu yang sama dengan waktu yang digunakan untuk melakukan pembakaran bensin dengan kendaraan bermotor selama 12 menit ternyata diperoleh kalor 22,5531 kJ. Jika dibandingkan kalor yang dihasilkan pada pembakaran 1 gram besin (oktana) dengan 1 gram gas Hidrogen = 48,333 kJ : 120,91 kJ. Dari hasil ini terlihat bahwa penambahan gas hidrogen dari elektrolisis kedalam ruang pembakaran akan menghasilkan tambahan energi yang cukup besar sehingga performa mesin akan lebih bagus dan lebih hemat dalam pemakaian bahan bakar.
2. Pada pembakaran bensin dalam bentuk uap di ruang pembakaran mesin ternyata belum dapat terbakar sempurna, terlihat dari hasil pembakaran masih terdapat 5% gas karbonmonoksida atau CO, ini dapat dipandang sebagai pemborosan energi. Hadirnya gas oksigen murni yang diperoleh dari hasil elektrolisa sebanyak 1,49223 gram atau 1,14027 Liter pada suhu kamar, kontribusi gas oksigen ini akan sangat besar didalam membantu proses pembakaran, diharapkan pembakaran yang terjadi akan semakin sempurna dan performa mesin akan semakin tinggi serta pemakaian bahan bakar kendaraan bermotor akan semakin efisien.
Pada sepeda motor 4 langkah konsumsi bahan bakar menjadi perhatian penting dikhawatirkan dengan CC yang besar konsumsi bahan bakar semakin meningkat. Maka dengan penggunaan HHO GENERATOR konsumsi bahan bakan menjadi lebih irit dibandingkan tidak menggunakan HHO GENERATOR. Dimana HHO GENERATOR mampu menggabungkan hydrogen dengan pengkabutan udara hasil dari bensin yang bercampur udara di ruang bakar kendaraan bermotor, yang menghasilkan efisiensi penggunaan bahan bakar sebesar 50% dari pemakaian normal.
Dengan memasang HHO GENERATOR di ruang mesin, isi HHO GENERATOR dengan air destilasi, aliri dengan listrik DC, dan HHO GENERATOR akan memproduksi gas HHO (hidrogen+oksigen) untuk disupply ke ruang bakar. Gas HHO disuplai ke ruang bakar melalui intake manifold atau filter udara.
Arus listrik ke HHO GENERATOR hidup hanya setelah kunci kontak diputar ke posisi ON. Setelah kunci kontak OFF, maka HHO Generator tidak bekerja. HHO GENERATOR disuplai dengan tegangan DC 12V, arus 5-25 A, dan tidak mengganggu kinerja alternator secara berlebihan, pada kendaraan roda dua (motor), DC 12V, arus 2-5 A.
HHO GENERATOR juga mampu meningkatkan performa laju kendaraan bermotor secara cukup signifikan, meninggalkan akselerasi spontan, dan memperpanjang umur komponen-komponen ruang bakar sepeda motor. Semakin besar perbandingan kompresi dari suatu motor maka semakin bagus kinerja yang dihasilkan oleh HHO GENERATOR.
HHO GENERATOR juga mampu meningkatkan performa laju kendaraan bermotor secara cukup signifikan, meninggalkan akselerasi spontan, dan memperpanjang umur komponen-komponen ruang bakar sepeda motor. Semakin besar perbandingan kompresi dari suatu motor maka semakin bagus kinerja yang dihasilkan oleh HHO GENERATOR.
Kesimplulannya Bahan bakar hidrogen tidak terjadi secara alami di Bumi sehingga bukanlah sumber energi, namun merupakan pembawa energi. Saat ini hidrogen paling sering dibuat dari metana atau bahan bakar fosil lainnya, yang membuatnya tidak sebersih produk akhir. Jawabannya terletak pada menghasilkan hidrogen dari air dengan menggunakan elektrolisis dengan adanya satu atau lebih katalis.
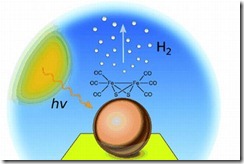
Ini Yang Sedang Di Kembangkan Yaitu Membuat Hidrogen dari air dengan menggunakan sinar matahari. Para peneliti di University of East Anglia telah melaporkan terobosan dalam generasi hidrogen dari air, dengan sistem baru yang mencapai efisiensi 60 persen untuk sebuah proses di mana hidrogen dihasilkan dari air oleh foton mencolok sebuah elektroda yang dirancang khusus. Teknologi ini didasarkan pada penggunaan nanophotocathode, yang dilapisi emas elektroda dengan nanoclusters dari phosphide indium.

Artikel ini Bersambung di Masa Depan .....Sampai Jumpa.....
Dari Berbagai Sumber
Air Bisa Jadi BBM
Air Menjadi Bahan Bakar
Air Laut Menjadi Bahan Bakar
Merubah Air Menjadi BBM
Manfaat Gas Hidrogen
Hidrogen Pangganti BBM
Dari Berbagai Sumber
Air Bisa Jadi BBM
Air Menjadi Bahan Bakar
Air Laut Menjadi Bahan Bakar
Merubah Air Menjadi BBM
Manfaat Gas Hidrogen
Hidrogen Pangganti BBM
https://beginicarabikinnya.blogspot.com/2015/09/cara-merubah-sendiri-air-h20-menjadi.html
Cara Merubah Sendiri Air H20 Menjadi Bahan Bakar Gas Hidrogen H2
4/
5
Oleh
topbanget










